En veille concurrentielle, dans le secteur pharmaceutique, une des surveillances clés est celle des essais cliniques menées par ses concurrents.
Un des sites mondiaux les plus connus et le plus visible référençant les essais cliniques est celui de la Foods & Drugs Administration , www.clinicaltrials.gov
NB: Dans cet article nous faisons référence à la nouvelle version du site clinicaltrials.gov, cette dernière ayant changée récemment. L’ancienne version et interface du site reste toujours valabe sur : classic.clinicaltrials.gov, d’ailleurs certaines fonctions de l’ancienne version peuvent toujours nous être utiles et quand ce sera le cas nous le préciserons.
Quelles sont les meilleures façons pour surveiller les essais cliniques de sociétés pharmaceutiques ? Quels trucs et astuces peuvent vous faciliter la vie ?
Voilà notre petit tuto en espérant qu’il vous soit utile.
Comment paramétrer sa surveillance
Un des gros avantages de clinicaltrials.gov est qu’il propose un flux RSS des recherches que vous pouvez effectuer sur le site ce qui facilite grandement la veille sur les résultats de recherche aussi bien pour les nouveaux essais cliniques que pour les modifications de ces derniers.
La recherche sur clinicaltrials.gov est très complète et propose de nombreux paramètres.
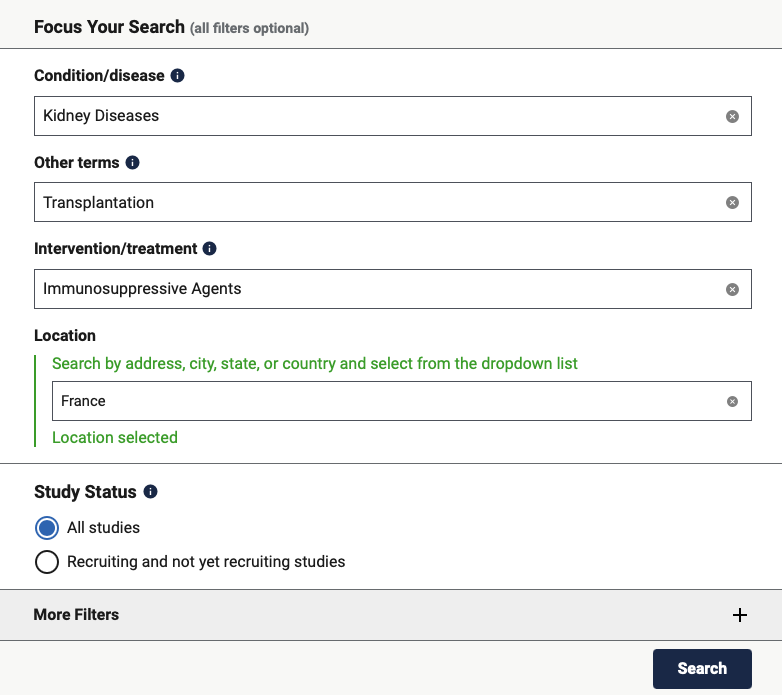
Par défaut le site vous propose une interface de recherche simple qui ne comporte que 5 champs :
- Condition / disease :
- Il vous est possible de cibler des essais cliniques ciblant certaines maladies ou conditions. Ce champ est utile quand vous voulez surveiller une aire thérapeutique en particulier et permet par ailleurs d’éviter le bruit lié à une recherche en texte libre. Par exemple si vous cherchez des essais cliniques portant sur le diabète mais que vous tapez le terme « diabetes » dans le champ suivant, « Other terms », vous obtiendrez les traitement appliqués aux diabétiques mais également les essais cliniques excluant les diabétiques. L’utilisation du champ conditions/diseases est donc fortement recommandé dès lors que vous surveillez une aire thérapeutique précise. Vous noterez que dès la saisie des première caractères, le formulaire de recherche vous propose les aires thérapeutiques qu’il reconnaît. Il faut donc sélectionner l’aire thérapeutique correspondante.
- Other terms :
- Il s’agit là de la recherche en texte libre qui va permettre soit d’être utilisée seule soit de faciliter le ciblage de votre recherche en complément des champs spécifiques. Il est possible par exemple d’ajouter le numéro d’un essai clinique ou bien de la société qui mène l’essai clinique, etc.Il faut noter que de nombreux champs complémentaire sont disponibles et que par exemple le numéro d’essai clinique peut également être renseigné dans le champs « Study IDs
- Ce champ de recherche accepte les expressions avancées reposant sur des opérateurs booléens.
- Pour recherche une chaîne de caractères exacte comportant plusieurs mots pensez à utiliser les guillemets.Vous pouvez utiliser le NOT qui vous permettra d’exclure certains mots par exemple influenza NOT seasonal.
- Et enfin il vous est possible d’utiliser l’opérateur AND pour demander la présence simultanée de deux mots dans l’essai clinique par exemple coronavirus AND influenza.
- Intervention/treatment :
- L’intervention / traitement permet de définir quel type de traitement ou d’intervention sera réalisé. Il peut par exemple s’agit d’un vaccin, de radiothérapie, diet (régime), etc…
- Ce champ n’est pas normé et son utilisation est très hétérogène par les sociétés déclarant les essais cliniques. Il est donc conseillé d’être prudent lorsque vous l’utilisez car vous risquez de passer à côté de nouveaux essais cliniques potentiels.
- Location :
- Ce champ permet de savoir où se déroule l’essai clinique. Là encore, le formulaire de recherche propose une saisie assistée reposant sur les lieux reconnus. Ce champ permet donc d’identifier un des centres d’essai cliniques déclaré spécifique par exemple. Pour les produits les plus importants, les essais cliniques de phase III sont souvent réalisés dans de nombreux pays car la réglementation de certains pays impose qu’un médicament soit testé dans une centre du dit pays pour pouvoir ensuite y être approuvé. La veille sur les localisations permet donc également d’avoir des indices sur les pays de commercialisation prioritairement ciblés.
- Il est également possible d’utiliser le champs « Facility name » dans le formulaire de recherche avancée.
- Study Status :
- Le statut de l’étude permet de savoir si l’essai clinique :
- N’a pas encore commencé son recrutement de patients (Not yet recruiting)
- Recrute actuellement des patients (Recruiting)
- Recrute des patients présélectionnés et n’est pas ouverte aux patients qui souhaiteraient participer à l’essai clinique hors ceux choisis par les chercheurs menant l’essai clinique (Enrolling by invitation)
- Commencée et certains patients reçoivent déjà des traitements mais ne recrute pas de nouveaux participants.
- Suspendue : l’étude est pour l’instant suspendue mais pourra éventuellement reprendre (Suspended).
- Terminée (Terminated) : l’étude a été interrompue prématurément et ne redémarrera pas. A ce stade plus aucun participant ne reçoit de traitement ou n’est examiné.
- Complétée (Completed) : l’étude s’est terminée normalement et les patients ne reçoivent plus de traitement et ne sont pas examinés.
- Retirée : (Withdrawn) : l’étude a été stoppée avant de recruter son premier patient.
- Inconnu (Unknown) : la date de finalisation de l’étude est dépassée et la dernière vérification de cet essai clinique date d’il y a plus de deux ans. Dans ce cas, clinicaltrials.gov considère l’étude en statut « Unknown ».
- Le statut de l’étude permet de savoir si l’essai clinique :
Le formulaire de recherche avancée vous permettra également de préciser de nombreux autres champs pour parvenir à une requête aussi précise que vous le souhaiterez parmis les plus essentiels.
Les tranches d’âges qui vous permettent de savoir si le traitement sera pour les personnes âgées, pour la pédiatrie ou pour les adultes entre 18 et 64 ans. Ce champ permet par exemple de détecter les traitements qui bénéficieraient déjà d’une approbation et chercheraient à décrocher une extension de prescription destinée à d’autres tranches d’âges.
La phase de l’étude clinique (Study phase) qui permet de savoir si l’essai clinique est sur une phase amont (Phase I) ou si elle est dans sa dernière phase avant une potentielle approbation (Phase III). La Phase IV quant à elle est une étude clinique relatif à un traitement déjà approuvé.
Le type de l’essai clinique (Study type) qui permet de savoir s’il s’agit d’un essai interventionnel – à proprement parler donc un essai clinique, ou bien s’il s’agit d’un essai observationnel (observationnal) c’est-à-dire un essai clinique dans lesquels des patients sont identifiés et ont pu recevoir des traitements ou intervention mais pas par le biais du responsable de cette étude clinique. Les études observationnelles peuvent être utilisées par exemple pour regrouper différents résultats d’essais cliniques et tirer des conclusions plus larges sur un traitement ou intervention. Enfin les études de type « accès étendu » sont des études ouvertes aux patients souffrant de maladies ou de conditions ne bénéficiant pas encore de traitement efficace approuvés et qui peuvent être autorisés à participer à des études les concernant.
Le champ de filtre reposant sur la disponibilité de résultats est important car il permet d’être de réaliser des requêtes spécifiques dès la publication des résultats. On notera qu’il arrive régulièrement que les résultats des essais cliniques soient disponibles ailleurs avant leur publication sur clinicaltrials.gov (par exemple dans des revues scientifiques). La FDA étant toutefois désormais beaucoup plus rigide sur la publication des résultats que par le passé, les résultats sont maintenant beaucoup plus facilement accessibles via ce site. Il faut toutefois noter que malgré la pression croissante de la FDA sur la piublication des résultats depuis 2021, malgré l’obligation des chercheurs de publier leur résultats sous un an (et ce depuis 2017), de nombreuses sociétés continuent à ne pas publier et que visiblement la FDA n’impose toujours pas d’amendes….
Les champs « sponsor or collaborator » et également « sponsor (Lead) » permettent d’identifier une société ou une organisation responsable ou impliquée sur un essai clinique. Il est particulièrement utile pour surveiller une entreprise en particulier.
Le champs « Study Ids » permet de se focaliser sur une étude en particulier. Ce champs prend en compte les identifiants essais cliniques de la base clinicaltrials.gov mais permet également d’isoler les identifiants d’essais cliniques déposés sur d’autres bases et ayant fait l’objet également d’un dépôt sur CT.gov.
Comment générer un flux RSS ?
Afin de bénéficier d’un flux RSS il vous faut auparavant rédiger votre recherche et en visualiser les résultats. Le flux RSS pourra donc être personnalisé de façon très précice, conformément à tous les paramètres de votre recherche.
Ici nous avons pris pour l’exemple :
- Les études portant sur les désordres liés à une transplantation (conditions / diseases : Transplant-Related Disorder)
- Phase III
- Completed
- With results
La mise en surveillance de cette requête nous permettra par exemple d’identifier toutes les études qui pourraient à l’avenir publier des résultats.
La génération de RSS passe par le biais de l’icône qui se trouve en haut à droite de la liste des résultats.
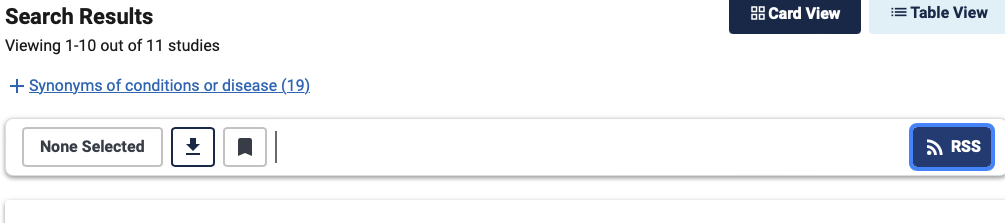
En cliquant dessus une fenêtre apparaît et vous permet de sélectionner le flux RSS que vous souhaitez.
Ils sont de deux types :
- Un flux RSS permettant d’identifier toutes les études cliniques nouvellement enregistrées sur le site CT.gov. Dans le cas de cet exemple précis de recherche, ce fil RSS ne sera pas très utile. A contrario, le RSS des nouvelles études cliniques permet d’identifier un nouvel essai clinique sur une aire thérapeutique ou d’une entreprise en particulier dès sa publication. Il sera par exemple ensuite possible de surveiller directement la page d’un essai clinique pour être tenu informé de ses modifications. Par défaut ce fil RSS de surveillance porte sur les 14 derniers jours.
- Un flux RSS qui permet d’identifier les nouveaux essais cliniques ou leurs modifications durant les 14 derniers jours. Dans notre exemple précis c’est ce flux RSS qu’il faudrait appliquer car il nous permettra d’identifier la publication de résultats d’une étude alors qu’elle est déjà enregistrée depuis longtemps sur le site CT.gov.
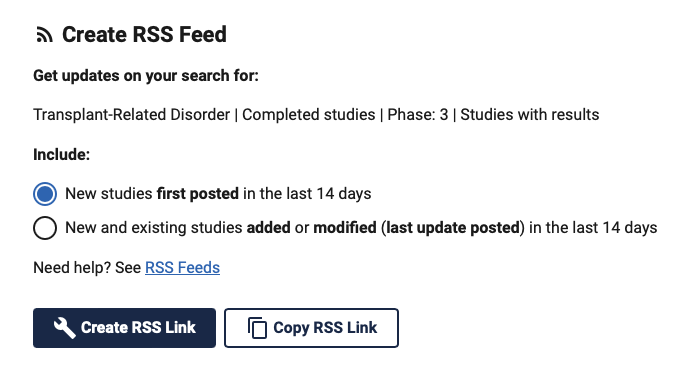
Une fois votre choix fait deux options s’offrent à vous :
- Create RSS feed : lorsque vous cliquez sur cette option, votre ordinateur essaiera de trouver une application de type lecteur RSS par défaut et ajoutera le fil RSS à cette dernière.
- Copy RSS link : le lien du flux RSS est copié dans votre presse papier et il sera alors de votre ressort d’aller le rajouter dans l’application RSS de votre choix ou dans votre logiciel de veille.
Pour le reste de la surveillance il vous faudra correctement paramétrer votre lecteur RSS pour être informé des mises à jour de ces flux RSS.
Toute un tas d’options sont potentiellement envisageables.
Si vous utilisez Inoreader vous pouvez par exemple vous appuyer sur les règles de tagging automatique et de notification internes à l’application ou bien encore utiliser IFTT par exemple pour le coupler à Inoreader et mettre en place des règles avancées de partage et de diffusion.
Si vous utilisez un logiciel de veille ous pourrez aller plus loin et par exemple récupérer l’intégralité de la page de l’essai clinique et non pas juste l’avis de mise à jour ou de mise à disposition.
Les limites principales des flux RSS De clinicaltirals.gov
Une des difficultés principales dans la surveillance des essais cliniques et l’identification des modifications survenues sur un essai clinique.
En effet lorsque vous consultez un essai clinique via le fil RSS vous accédez directement à la dernière version et les modifications ne sont pas explicites. Par exemple le fil RSS pourra vous préciser si le statut de l’étude a changé mais ce sera à vous d’aller vérifier le statut précédent en utilisant la comparaison des versions.
Pour cela il faudra vous rendre dans le bas de la page de l’essai clinique et cliquer sur « Record history ». Cela vous permettra de choisir les versions des essais cliniques que vous souhaitez surveiller et de visualiser les différences. Le problème est que cela peut s’avérer un peu fastidieux.
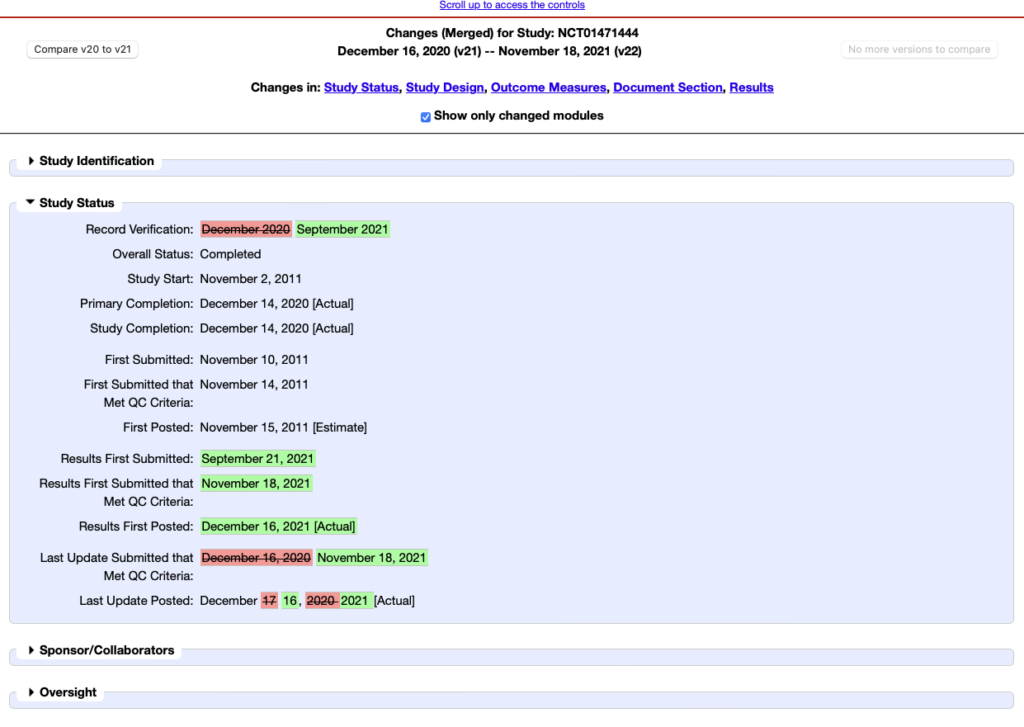
Si vous désirez suivre tous les changements survenant sur un essai clinique il peut être plus efficace de surveiller directement chaque essai clinique par le biais d’un logiciel de veille qui fera la copie de la page de départ et pourra ensuite vous faire apparaître directement les changements.
La plupart des logiciels de veille professionnels disposent de cette fonction de surveillance de page et de notification des modifications et vous pouvez également vous appuyer sur des logiciels moins coûteux tels que le plugin Update scanner, la solutions SaaS distill.io ou changedetection.io.
Les options sont nombreuses mais notez toutefois que certains logiciels peuvent échouer à surveiller efficacement un essai clinique en raison de la mise en forme HTML de la page reposant sur des tableaux ou encore du site lui-même interdisant l’accès à certains crawlers.
Une autre des limites des flux RSS pour la surveillance des essais cliniques est la publication des résultats. Il arrive souvent que l’on soit notifié d’une modification d’un essai clinique et lorsque l’on regarde le « Record History » la dernière version de l’essai clinique soit antérieure à la date de notification de dernière modification. Cela se produit souvent lors de la publication des résultats qui sont parfois accessibles plusieurs jours après la notification. Il sera alors impératif de revenir plus tard sur l’essai clinique pour consulter ses résultats.
- Les autres sites d’essais cliniques
Si le site clinicaltrials.gov est incontournable en veille concurrentielle dans le secteur pharmaceutique, d’autres pays tiennent à jour des bases de données des essais cliniques.
Le site de l’OMS les référence d’une façon exhaustive sur ces deux pages, l’une pour les fournisseurs primaires et l’autre pour les partenaires:
NB: le site des essais cliniques fournie par l’OMS intègre un nombre important de bases de données d’essais cliniques locales ce qui est pratique, permettant de centraliser la veille plutôt que de surveiller les différents registres. Toutefois, les données sont parfois déversées dans le méta moteur de l’OMS de façon trés tardive rendant ce qui nous semble gênant en termes de performance et de réactivité de la veille menée. Par ailleurs le site de l’OMS ne fournit pas une recherche aussi précise au niveau des champs et ne fournit pas non plus de RSS
Actulligence est spécialisée dans la mise en place de projets de veille et réalise également des veilles stratégiques et concurrentielles au quotidien pour ses clients. Nous sommes à même de travailler avec la plupart des logiciels de veille professionnels du marché, de les paramétrer, de mainteir la connexion aux sources. Nous travaillons sur des sources simples ou complexes pour permettre d’identifier au plus vite les informations utiles à nos clients. Nous travaillons sur des projets sur mesure vous permettant de vous assurer que les sources les plus utiles pour vous alimentent votre vision stratégique au quotidien.




